北京时间2026年1月22日凌晨,国际学术期刊《自然》(Nature)在线发表华中农大生物医学与健康学院颜彦教授团队联合美国纪念斯隆–凯特琳癌症中心Tuomas Tammela教授团队的合作研究成果,首次精准定位并证实肺癌中存在“高可塑性细胞状态(HPCS)”的特殊肿瘤细胞,其作为肿瘤内部的“交通枢纽”,是驱动癌症进展、产生治疗耐受的关键源头,为新型抗癌策略研发奠定重要基础。
恶性肿瘤的难治与复发,核心症结在于肿瘤细胞能在不同状态间切换以逃避治疗。长期以来,科学界始终探寻是否存在调控这一过程的“枢纽状态”,但因缺乏活体肿瘤中精准标记、追踪及干预的技术体系,该问题一直未能破解。
针对这一技术瓶颈,研究团队构建了新型遗传报告系统,相当于为肿瘤细胞装上“可追踪芯片”和“定点清除开关”,实现对特定细胞状态的原位精准标记、纵向谱系追踪及定点特异性清除,为解析细胞状态转换的因果关系提供了关键技术支撑。
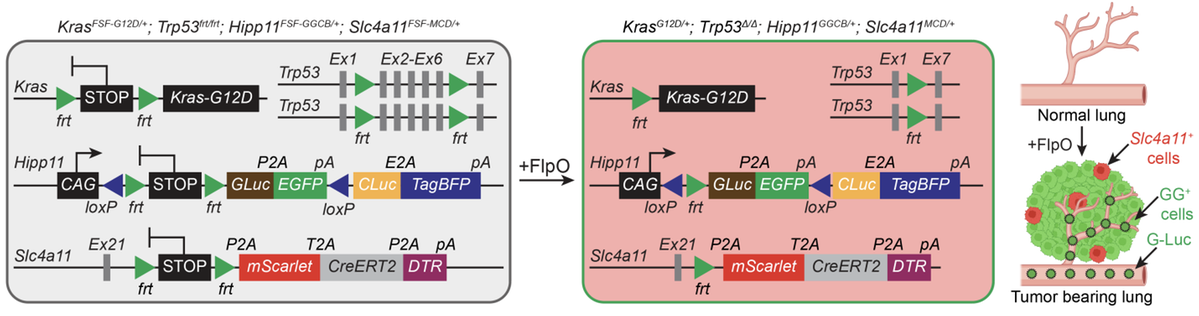
借助该系统,研究团队成功鉴定出HPCS细胞群体。这类细胞展现出双向、非线性的高可塑性特征:既能分化产生各类肿瘤细胞,已分化细胞也能“逆向”回归该状态。若将肿瘤比作动态交通网络,HPCS便是核心“交通枢纽”,细胞可经此向不同分化路径转换,也能回流维持肿瘤异质性与演进潜能。
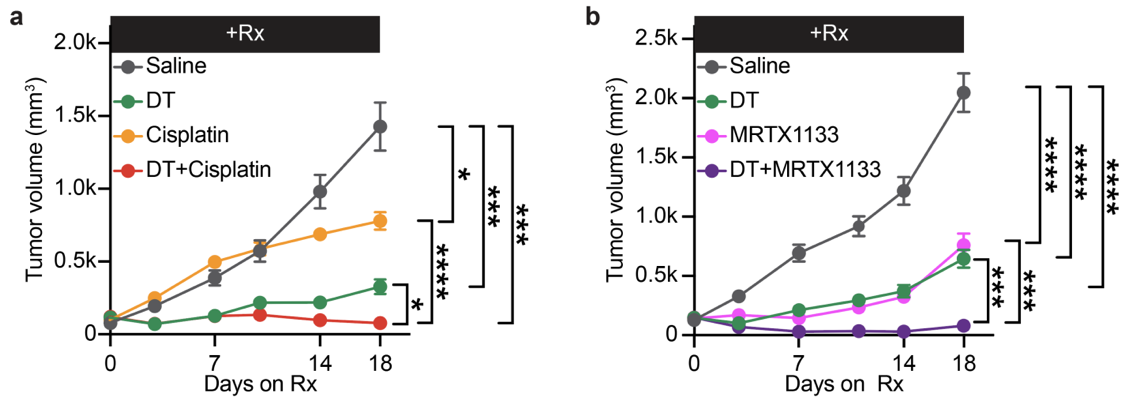
特异性消融高可塑性细胞状态联合化疗(a)或靶向治疗(b)实现对肿瘤的清除
值得关注的是,HPCS本身并非高度增殖状态,而呈“低活性预备”特征,脱离该状态后才会启动增殖程序,成为驱动肿瘤生长的“主力”。这一发现揭示了全新组织原则:HPCS并非直接参与肿瘤扩张的“战斗单元”,而是持续供应“高增殖潜能细胞”的“指挥中枢”。实验证实,早期清除HPCS可阻断肿瘤向恶性演进,晚期靶向清除则能显著抑制肿瘤生长,证实其是肺癌恶变与维持增殖能力的关键源头。
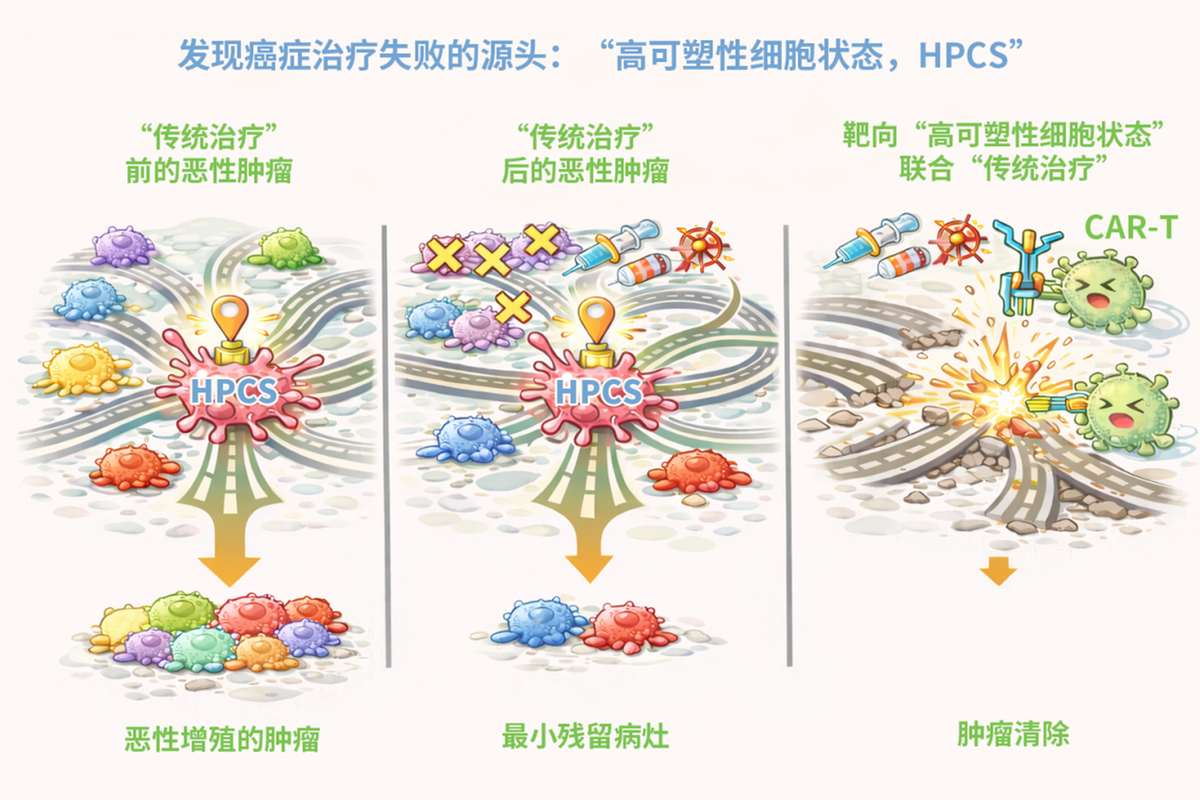
高可塑性细胞状态作为肿瘤内状态转换的“中枢节点”,驱动肺癌进展与治疗耐受
研究进一步发现,临床治疗后导致复发的“最小病灶”主要来源于HPCS,且该细胞高表达uPAR分子标识。基于此,团队采用靶向uPAR的CAR-T免疫细胞治疗,成功清除HPCS并延缓肿瘤进展;而靶向清除HPCS联合常规化疗或靶向药,在动物实验中几乎实现肿瘤完全清除,首次证实驱动治疗耐受的核心细胞状态具备可靶向性。

华中农大颜彦教授与学生们一起讨论研究成果(匡敏 摄)
此外,HPCS的分子特征在多种实体瘤中高度保守,且与正常组织损伤修复中的“再生细胞状态”相似,提示肿瘤可能“劫持”机体再生修复程序获得持续进化能力。该研究为理解癌症可塑性提供了全新理论框架,指明了靶向肿瘤细胞状态转换的治疗新路径,有望从根本上抑制肿瘤复发与耐药,为癌症根治带来新希望。
(中国日报湖北记者站 编辑:刘坤 通讯员:高雅婧)